- PHOTOCHIMIE
- PHOTOCHIMIELa photochimie est l’étude de l’action de la lumière sur les réactions chimiques. D’une façon plus précise, elle regroupe les travaux dont la finalité est de déterminer la nature des états excités réactifs des molécules obtenues par absorption de la lumière, d’étudier les processus de désactivation de ces états, notamment ceux qui conduisent à des produits différents des réactifs irradiés et d’établir les mécanismes selon lesquels s’opèrent les réarrangements intraet intermoléculaires initiés par le rayonnement.Par comparaison aux processus chimiques qui ont lieu dans l’obscurité et qui sont le fait de molécules en équilibre thermique avec leur environnement, la photochimie est le domaine d’étude d’un milieu réactionnel dans lequel des molécules d’une espèce donnée se trouvent sélectivement portées dans un état excité métastable riche en énergie, et qui ne pourrait être obtenu qu’en chauffant le mélange à des températures très élevées sans distinction d’espèces possible.Dans certains cas, l’action de la lumière peut être assimilée à celle d’un catalyseur qui facilite une réaction dont l’énergie d’activation est élevée. C’est ce qu’on observe en irradiant un mélange d’hydrogène et de chlore qui réagit explosivement pour donner le chlorure d’hydrogène (HCl). Dans d’autres cas, la lumière est indispensable au déroulement de la réaction qui n’aurait pas lieu sans apport d’énergie; la transformation de l’oxygène en ozone en est un exemple.En outre, les molécules excitées peuvent souvent être considérées comme de nouvelles espèces chimiques, car leur géométrie et leur répartition électronique sont presque toujours différentes de celles des molécules non irradiées que l’on dit être dans leur état fondamental. Un exemple illustrant bien ce cas est celui de l’éthylène et de ses dérivés comme le dichloréthylène dont les molécules sont planes à l’état fondamental et non planes à l’état excité, les plans des deux groupements H 漣 C 漣 Cl faisant un angle de 900 entre eux.Les radiations actives en photochimie sont essentiellement les rayonnements électromagnétiques dans le domaine du visible et de l’ultraviolet. Depuis quelques années, on assiste à un élargissement du domaine d’action spectrale, d’une part vers les courtes longueurs d’onde de l’ultraviolet que fournissent les lasers à excimères et l’ultraviolet sous vide et d’autre part vers les grandes longueurs d’ondes de l’infrarouge grâce aux lasers à C2.HistoriqueUne légende rapporte qu’Alexandre le Grand avait muni ses soldats de bracelets en tissu imprégné d’une substance qui changeait de couleur selon l’heure, sous l’influence de la lumière du soleil. Mais, bien que l’on sache depuis longtemps que la lumière peut provoquer des transformations chimiques, les études quantitatives et systématiques n’ont été entreprises que depuis le milieu du siècle dernier.Le lien entre la lumière absorbée et l’effet chimique qui en résulte a été tout d’abord clairement perçu, à partir de considérations théoriques, par T. von Grotthuss en 1817 et redécouvert, en 1841, par J. W. Draper, à la suite de ses expériences sur la combinaison de l’hydrogène avec le chlore. La loi énoncée alors, qui porte le nom de Grotthuss-Draper, dit que seules les radiations absorbées par les espèces chimiques peuvent provoquer une réaction photochimique.On chercha alors pendant longtemps à relier l’avancement de la réaction photochimique à la quantité d’énergie absorbée, mesurée en ergs, en calories, etc., mais aucune relation simple ne put être trouvée avant l’introduction des quanta en physique. À la suite des travaux d’Einstein (1905-1912) et de Stark (1908), complétés par ceux de Bohr (1916), se dégagea la loi de l’équivalent photochimique selon laquelle chaque molécule réagissant sous l’influence de la lumière absorbe un quantum d’énergie électromagnétique h 益 qui provoque sa transformation: h est la constante de Planck, 6,63 憐 10 size=1漣34 joule-seconde, et 益 la fréquence du rayonnement absorbé.Ainsi, pour un même nombre de photons absorbés, l’énergie apportée dépend de la fréquence 益 du rayonnement, donc de sa longueur d’onde, puisque, c étant la vitesse de la lumière,益 = c. Le tableau ci-contre donne quelques valeurs de l’énergie d’un photon exprimée en électrons-volts et de celle d’une «mole» de photons (6,02 憐 1023 photons ou 1 einstein).Dans le contexte actuel de nos connaissances sur la matière et sur le rayonnement électromagnétique, les lois de Grotthuss-Draper et de Stark-Einstein peuvent sembler évidentes. Même les exceptions qui sont apparues récemment, lorsqu’on utilise les sources de lumière particulières que constituent les lasers, sont aujourd’hui bien comprises. Le rayonnement cohérent et intense émis par ces dispositifs peut en effet exciter des composés dans un domaine où la lumière n’est pas absorbée par les molécules. Il se trouve qu’en présence d’un rayonnement très monochromatique et présentant des propriétés de cohérence spatiale, la probabilité d’absorption de deux photons, voire trois photons simultanément, devient non négligeable. C’est ainsi que certains phénomènes produits en éclairant habituellement avec de la lumière de longueur d’onde 347,3 nm peuvent également être observés si l’on irradie avec un laser à rubis émettant une lumière de longueur d’onde 694,6 nm double de la précédente, dont les photons ont une énergie inférieure de moitié à l’énergie des photons de longueur d’onde 347,3 nm, à la suite de l’absorption simultanée de deux photons.Théorie de la photochimieRendement quantique primaire et rendement quantique globalLa notion de rendement quantique est très importante en photochimie. Ce rendement, désigné le plus souvent par 淋, a été défini à l’origine comme étant le nombre de molécules du réactif soumis au rayonnement, ayant donné lieu à une réaction photochimique par photon absorbé.Soit une réaction qui est représentée par: A h 益produits. On a par définition:
 ou:
ou: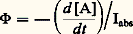 en faisant apparaître la vitesse de disparition de A, (face=F0019 漣 d [A]/dt ), l’intensité lumineuse absorbée Iabs et en prenant comme unité la mole.Si une réaction avait lieu chaque fois qu’un photon est absorbé par une molécule, les rendements quantiques seraient tous égaux à l’unité. Or les rendements mesurés varient énormément d’une réaction à l’autre. On trouve des valeurs élevées telles que celles (de 104 à 106) de la réaction du chlore sur l’hydrogène. 淋 est très rarement égal à un, comme c’est le cas lorsqu’on éclaire de la benzophénone dissoute dans de l’alcool éthylique:
en faisant apparaître la vitesse de disparition de A, (face=F0019 漣 d [A]/dt ), l’intensité lumineuse absorbée Iabs et en prenant comme unité la mole.Si une réaction avait lieu chaque fois qu’un photon est absorbé par une molécule, les rendements quantiques seraient tous égaux à l’unité. Or les rendements mesurés varient énormément d’une réaction à l’autre. On trouve des valeurs élevées telles que celles (de 104 à 106) de la réaction du chlore sur l’hydrogène. 淋 est très rarement égal à un, comme c’est le cas lorsqu’on éclaire de la benzophénone dissoute dans de l’alcool éthylique: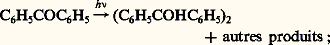 le plus souvent, les valeurs de 淋 sont très inférieures, par exemple 0,02, quand la benzophénone est irradiée dans l’eau.Ces résultats, et tout particulièrement le premier, ne sont compatibles avec la loi de Stark-Einstein que si l’on distingue le rendement quantique primaire du rendement quantique global de la réaction. Pour déterminer le rendement quantique primaire, on essaye de ne tenir compte que de la première étape de désactivation des molécules excitées, laissant de côté les réactions secondaires, qui sont des réactions d’«obscurité» obéissant aux lois de la cinétique chimique classique.Ainsi, dans le cas de la photolyse du chlore en présence d’hydrogène, on peut distinguer les étapes suivantes:– l’étape zéro correspond à l’excitation des molécules de chlore:
le plus souvent, les valeurs de 淋 sont très inférieures, par exemple 0,02, quand la benzophénone est irradiée dans l’eau.Ces résultats, et tout particulièrement le premier, ne sont compatibles avec la loi de Stark-Einstein que si l’on distingue le rendement quantique primaire du rendement quantique global de la réaction. Pour déterminer le rendement quantique primaire, on essaye de ne tenir compte que de la première étape de désactivation des molécules excitées, laissant de côté les réactions secondaires, qui sont des réactions d’«obscurité» obéissant aux lois de la cinétique chimique classique.Ainsi, dans le cas de la photolyse du chlore en présence d’hydrogène, on peut distinguer les étapes suivantes:– l’étape zéro correspond à l’excitation des molécules de chlore: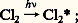 – l’étape photochimique primaire qui fait suite dissocie les molécules de chlore excitées ( 淋 黎 1):
– l’étape photochimique primaire qui fait suite dissocie les molécules de chlore excitées ( 淋 黎 1):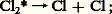 – les étapes secondaires correspondent à la propagation de la chaîne:
– les étapes secondaires correspondent à la propagation de la chaîne: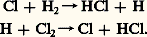 Il est à noter que les atomes de chlore formés par la photodissociation des molécules Cl2 déclenchent une réaction en chaîne qui multiplie l’effet d’un photon, mais pour laquelle la lumière ne joue plus aucun rôle.Processus de désactivation des états excitésD’une façon générale, les processus photochimiques font partie des différents modes de désactivation des molécules préalablement portées dans leurs états excités métastables par absorption d’un photon.Le schéma qui rend le plus clairement compte des phénomènes d’absorption et de désactivation est celui connu sous le nom de diagramme de Jablonski-Perrin. Soit une molécule AB représentée sur la figure 1 dans son état fondamental singulet par 1AB0. L’exposant 1 indique que l’état est singulet, c’est-à-dire que la molécule, comme c’est presque toujours le cas, a tous ses électrons appariés; elle est diamagnétique. Le niveau d’énergie électronique le plus bas, dit fondamental, est représenté schématiquement par un trait plein.L’excitation par un rayonnement lumineux d’énergie appropriée va promouvoir un des électrons dans un niveau d’énergie électronique supérieur et provoquer des vibrations complexes de la molécule. Cette excitation, qui a lieu dans un temps de l’ordre de 10 size=1漣17 s, est représentée par une flèche verticale orientée vers le haut.Par une redistribution de l’énergie vibrationnelle, les molécules retombent très rapidement, en 10 size=1漣13 s, dans le premier état électronique excité singulet, 1AB, en équilibre vibrationnel avec le milieu extérieur. La durée de vie de cet état est longue, de 10 size=1漣9 à 10 size=1漣7 s, comparativement aux autres états excités. À partir de cet état, plusieurs processus de désactivation sont possibles. Il y a tout d’abord la perte radiative d’énergie d’excitation par émission d’un photon, processus inverse de l’absorption, appelé fluorescence (flèche en trait plein vertical, orientée vers le bas). L’énergie peut être perdue par des processus non radiatifs schématisés par des flèches en zigzag: désactivation en cascade par couplage vibrationnel avec le milieu extérieur appelée conversion interne, ou désactivation par des molécules particulières M que les Anglo-Saxons appellent quenchers . L’énergie peut être perdue par transfert à une autre molécule voisine CD dont le premier niveau excité, 1CD, correspond sensiblement à celui de 1AB.À ces modes de désactivation physique, puisqu’en fin de compte on retrouve la molécule inchangée, s’en ajoute un autre dont l’importance en photochimie est apparue clairement depuis les travaux de G. N. Lewis. Il s’agit de ce qu’il est convenu d’appeler le «passage intersystème» qui transforme la molécule de son état singulet 1AB, en état triplet 3AB, c’est-à-dire dans lequel deux électrons ne sont plus appariés, mais présentent des spins parallèles. La molécule est alors paramagnétique. Cette transformation, qui est théoriquement interdite lorsqu’on néglige les couplages entre mouvements de spin et mouvements orbitaux, se produit en fait, dans certains cas, avec un rendement proche de l’unité.Les molécules dans l’état triplet le plus bas présentent, outre les caractéristiques de celles qui sont dans le premier état singulet excité, deux propriétés qui retiennent tout particulièrement l’attention des photochimistes: une distribution électronique différente de celle des états singulets et, surtout, une durée de vie relativement longue allant de 10 size=1漣6 à 10 size=1漣3 s dans le cas de solutés en solution fluide, et de 10 size=1漣3 à quelques secondes en milieu rigide.La désactivation de l’état 3AB peut également prendre les mêmes chemins que ceux du premier état singulet excité: émission de photons (phosphorescence), désactivation non radiative, transfert d’énergie, etc.La désactivation physique des états excités singulet ou triplet peut être concurrencée par une désactivation qui résulte d’une transformation chimique de la molécule. Ce processus peut théoriquement avoir lieu aussi bien à partir de l’état 1AB qu’à partir de 3AB. S’il s’agit cependant d’une réaction bimoléculaire nécessitant donc la rencontre de deux molécules, il est beaucoup plus probable que ce sont les molécules dans leur état triplet qui réagissent, étant donné que leur durée de vie est plus longue que celle à l’état singulet.Le schéma réactionnel type peut s’écrire:
Il est à noter que les atomes de chlore formés par la photodissociation des molécules Cl2 déclenchent une réaction en chaîne qui multiplie l’effet d’un photon, mais pour laquelle la lumière ne joue plus aucun rôle.Processus de désactivation des états excitésD’une façon générale, les processus photochimiques font partie des différents modes de désactivation des molécules préalablement portées dans leurs états excités métastables par absorption d’un photon.Le schéma qui rend le plus clairement compte des phénomènes d’absorption et de désactivation est celui connu sous le nom de diagramme de Jablonski-Perrin. Soit une molécule AB représentée sur la figure 1 dans son état fondamental singulet par 1AB0. L’exposant 1 indique que l’état est singulet, c’est-à-dire que la molécule, comme c’est presque toujours le cas, a tous ses électrons appariés; elle est diamagnétique. Le niveau d’énergie électronique le plus bas, dit fondamental, est représenté schématiquement par un trait plein.L’excitation par un rayonnement lumineux d’énergie appropriée va promouvoir un des électrons dans un niveau d’énergie électronique supérieur et provoquer des vibrations complexes de la molécule. Cette excitation, qui a lieu dans un temps de l’ordre de 10 size=1漣17 s, est représentée par une flèche verticale orientée vers le haut.Par une redistribution de l’énergie vibrationnelle, les molécules retombent très rapidement, en 10 size=1漣13 s, dans le premier état électronique excité singulet, 1AB, en équilibre vibrationnel avec le milieu extérieur. La durée de vie de cet état est longue, de 10 size=1漣9 à 10 size=1漣7 s, comparativement aux autres états excités. À partir de cet état, plusieurs processus de désactivation sont possibles. Il y a tout d’abord la perte radiative d’énergie d’excitation par émission d’un photon, processus inverse de l’absorption, appelé fluorescence (flèche en trait plein vertical, orientée vers le bas). L’énergie peut être perdue par des processus non radiatifs schématisés par des flèches en zigzag: désactivation en cascade par couplage vibrationnel avec le milieu extérieur appelée conversion interne, ou désactivation par des molécules particulières M que les Anglo-Saxons appellent quenchers . L’énergie peut être perdue par transfert à une autre molécule voisine CD dont le premier niveau excité, 1CD, correspond sensiblement à celui de 1AB.À ces modes de désactivation physique, puisqu’en fin de compte on retrouve la molécule inchangée, s’en ajoute un autre dont l’importance en photochimie est apparue clairement depuis les travaux de G. N. Lewis. Il s’agit de ce qu’il est convenu d’appeler le «passage intersystème» qui transforme la molécule de son état singulet 1AB, en état triplet 3AB, c’est-à-dire dans lequel deux électrons ne sont plus appariés, mais présentent des spins parallèles. La molécule est alors paramagnétique. Cette transformation, qui est théoriquement interdite lorsqu’on néglige les couplages entre mouvements de spin et mouvements orbitaux, se produit en fait, dans certains cas, avec un rendement proche de l’unité.Les molécules dans l’état triplet le plus bas présentent, outre les caractéristiques de celles qui sont dans le premier état singulet excité, deux propriétés qui retiennent tout particulièrement l’attention des photochimistes: une distribution électronique différente de celle des états singulets et, surtout, une durée de vie relativement longue allant de 10 size=1漣6 à 10 size=1漣3 s dans le cas de solutés en solution fluide, et de 10 size=1漣3 à quelques secondes en milieu rigide.La désactivation de l’état 3AB peut également prendre les mêmes chemins que ceux du premier état singulet excité: émission de photons (phosphorescence), désactivation non radiative, transfert d’énergie, etc.La désactivation physique des états excités singulet ou triplet peut être concurrencée par une désactivation qui résulte d’une transformation chimique de la molécule. Ce processus peut théoriquement avoir lieu aussi bien à partir de l’état 1AB qu’à partir de 3AB. S’il s’agit cependant d’une réaction bimoléculaire nécessitant donc la rencontre de deux molécules, il est beaucoup plus probable que ce sont les molécules dans leur état triplet qui réagissent, étant donné que leur durée de vie est plus longue que celle à l’état singulet.Le schéma réactionnel type peut s’écrire: Techniques et applicationsTechniques photochimiquesIdéalement, une expérience en photochimie est effectuée en irradiant l’échantillon avec une lumière monochromatique, puisque la réaction peut dépendre de la longueur d’onde excitatrice. La plupart des sources lumineuses étant polychromatiques, la lumière actinique est sélectionnée soit par des filtres, soit par un monochromateur.Les sources de lumière sont aujourd’hui presque toujours des tubes à décharges contenant soit du xénon, soit de la vapeur de mercure seule ou en présence d’impuretés soigneusement choisies. Certaines de ces lampes sont très puissantes; elles peuvent consommer plusieurs dizaines de kilowatts d’énergie électrique.Pour établir le mécanisme d’une réaction photochimique ou déterminer les étapes primaires de la réaction, il est indispensable de mettre clairement en évidence les espèces labiles intermédiaires qui se forment au cours de la réaction. Une technique d’une grande portée et bien adaptée à la détection d’espèces de courte durée de vie, formées consécutivement à l’absorption d’un photon, est celle qui a été mise au point et développée par R. G. W. Norrish et G. Porter à partir de 1950, et connue sous le nom de photolyse éclair ou spectroscopie par éclair. Le principe en est simple: il s’agit de créer dans un temps très court, par un éclair bref mais intense, une concentration d’espèces transitoires suffisante pour qu’elles soient observées par spectroscopie et que l’on puisse suivre leur évolution dans le temps. Les éclairs étaient produits par la décharge de condensateurs dans des tubes remplis de gaz sous de faibles pressions fournissant des impulsions lumineuses dont la durée de vie pouvait difficilement être inférieure à quelques microsecondes. Des centaines de réactions ont été ainsi étudiées, des mécanismes proposés et de nombreux radicaux mis en évidence. La photolyse éclair a tout particulièrement bien montré le rôle joué par les molécules dans leur état triplet au cours de réactions photochimiques.Une amélioration sensible de cette technique est apparue avec l’utilisation, comme source d’excitation brève, de lasers pulsés. Le seuil de la nanoseconde, 10 size=1漣9, puis celui de la picoseconde, 10 size=1漣12, voire quelques dixièmes de picosecondes, ont été ainsi atteints.Les réactions chimiques photosensibiliséesLes réactions chimiques provoquées indirectement par la lumière à la suite de transferts d’énergie électronique représentent un domaine d’étude et d’application connu depuis longtemps (F. Weigert, 1907) et très développé actuellement.Un composé D, appelé donneur ou photosensibilisateur, absorbe la lumière incidente qui porte ses molécules tout d’abord dans leur état singulet, et par suite éventuellement dans leur état triplet, comme il a été vu précédemment. Toute cette énergie électronique peut être cédée directement aux molécules d’un autre composé A appelé accepteur, intimement mélangé au premier, qui se trouve ainsi porté à son tour dans un état excité électronique. Le cas le plus intéressant est celui du transfert appelé triplet-triplet:
Techniques et applicationsTechniques photochimiquesIdéalement, une expérience en photochimie est effectuée en irradiant l’échantillon avec une lumière monochromatique, puisque la réaction peut dépendre de la longueur d’onde excitatrice. La plupart des sources lumineuses étant polychromatiques, la lumière actinique est sélectionnée soit par des filtres, soit par un monochromateur.Les sources de lumière sont aujourd’hui presque toujours des tubes à décharges contenant soit du xénon, soit de la vapeur de mercure seule ou en présence d’impuretés soigneusement choisies. Certaines de ces lampes sont très puissantes; elles peuvent consommer plusieurs dizaines de kilowatts d’énergie électrique.Pour établir le mécanisme d’une réaction photochimique ou déterminer les étapes primaires de la réaction, il est indispensable de mettre clairement en évidence les espèces labiles intermédiaires qui se forment au cours de la réaction. Une technique d’une grande portée et bien adaptée à la détection d’espèces de courte durée de vie, formées consécutivement à l’absorption d’un photon, est celle qui a été mise au point et développée par R. G. W. Norrish et G. Porter à partir de 1950, et connue sous le nom de photolyse éclair ou spectroscopie par éclair. Le principe en est simple: il s’agit de créer dans un temps très court, par un éclair bref mais intense, une concentration d’espèces transitoires suffisante pour qu’elles soient observées par spectroscopie et que l’on puisse suivre leur évolution dans le temps. Les éclairs étaient produits par la décharge de condensateurs dans des tubes remplis de gaz sous de faibles pressions fournissant des impulsions lumineuses dont la durée de vie pouvait difficilement être inférieure à quelques microsecondes. Des centaines de réactions ont été ainsi étudiées, des mécanismes proposés et de nombreux radicaux mis en évidence. La photolyse éclair a tout particulièrement bien montré le rôle joué par les molécules dans leur état triplet au cours de réactions photochimiques.Une amélioration sensible de cette technique est apparue avec l’utilisation, comme source d’excitation brève, de lasers pulsés. Le seuil de la nanoseconde, 10 size=1漣9, puis celui de la picoseconde, 10 size=1漣12, voire quelques dixièmes de picosecondes, ont été ainsi atteints.Les réactions chimiques photosensibiliséesLes réactions chimiques provoquées indirectement par la lumière à la suite de transferts d’énergie électronique représentent un domaine d’étude et d’application connu depuis longtemps (F. Weigert, 1907) et très développé actuellement.Un composé D, appelé donneur ou photosensibilisateur, absorbe la lumière incidente qui porte ses molécules tout d’abord dans leur état singulet, et par suite éventuellement dans leur état triplet, comme il a été vu précédemment. Toute cette énergie électronique peut être cédée directement aux molécules d’un autre composé A appelé accepteur, intimement mélangé au premier, qui se trouve ainsi porté à son tour dans un état excité électronique. Le cas le plus intéressant est celui du transfert appelé triplet-triplet: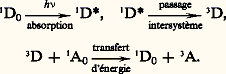 Les molécules dans leur état 3A peuvent réagir ou se désactiver, comme si elles avaient été excitées directement. La vapeur de mercure éclairée par une lampe à vapeur de mercure donne lieu ainsi à de nombreux cas de photosensibilisation.La photosensibilisation permet, par exemple, de peupler un état triplet sans passer par l’état singulet du composé accepteur, ce qui peut être utile si le passage intersystème se fait avec un très faible rendement ou si des réactions parasites se produisent à partir de l’état excité singuler 1A. Elle a, par contre, des effets fâcheux sur la stabilité des matériaux apparemment transparents soumis à la lumière solaire. En effet, les composés constituant ces matériaux contiennent immanquablement des impuretés qui absorbent la lumière et transfèrent l’énergie aux molécules voisines susceptibles alors de se dégrader. C’est le cas par exemple des plastiques.Applications de la photochimieParmi les réactions photochimiques les mieux comprises, on peut citer l’isomérisation cis-trans des composés alcéniques par excitation directe (état singulet excité) ou photosensibilisée (état triplet). En prenant le cas du 1,2 dichloroéthylène déjà cité à propos de la différence de conformation des molécules à l’état fondamental et à l’état excité, on comprend facilement que la désactivation de l’état excité peut aussi bien conduire à la molécule initiale cis qu’à la molécule trans .Un résultat spectaculaire annoncé dans les années soixante concerne l’isomérisation du benzène à l’état liquide qui donne (fig. 2), sous l’influence d’un rayonnement de longueur d’onde 253,7 nm (lampe à vapeur de mercure), du benzvalène (a) et du fulvène (b), alors que, irradié dans le domaine 166-200 nm, il donne du fulvène (a), du benzvalène (b) et du benzène dit de Dewar (c):Les réactions photochimiques ont eu, sans aucun doute, un rôle déterminant dans l’évolution de l’atmosphère terrestre et, par voie de conséquence, dans la vie sur notre planète.Avant l’apparition de la vie, la source principale d’oxygène a dû être la photolyse de l’eau, mais la concentration devait être très faible, environ mille fois moins élevée que la concentration actuelle. Cela semble confirmé par le fait que les molécules qui sont à l’origine des substances du monde vivant sont détruites par la lumière solaire en présence d’oxygène. La quantité actuelle d’oxygène est due essentiellement au processus de photosynthèse.Un problème qui revêt aujourd’hui une grande importance est la pollution atmosphérique dont certains aspects sont d’ordre photochimique (smog photochimique). La lumière solaire agissant sur le mélange gazeux issu des tuyaux d’échappement des automobiles et constitué par de l’oxyde nitrique NO et des hydrocarbures, en présence d’oxygène, produit de l’ozone 3 et de l’anhydride nitreux 2 en quantité suffisante parfois, par exemple à Los Angeles, pour irriter les voies respiratoires et colorer l’atmosphère.La photosynthèse est certes le processus biologique le plus important dépendant de la lumière. La lumière du soleil absorbée par la chlorophylle, associée à d’autres composés dans le chloroplaste, donne lieu à des réactions complexes que l’on peut globalement et schématiquement représenter par:
Les molécules dans leur état 3A peuvent réagir ou se désactiver, comme si elles avaient été excitées directement. La vapeur de mercure éclairée par une lampe à vapeur de mercure donne lieu ainsi à de nombreux cas de photosensibilisation.La photosensibilisation permet, par exemple, de peupler un état triplet sans passer par l’état singulet du composé accepteur, ce qui peut être utile si le passage intersystème se fait avec un très faible rendement ou si des réactions parasites se produisent à partir de l’état excité singuler 1A. Elle a, par contre, des effets fâcheux sur la stabilité des matériaux apparemment transparents soumis à la lumière solaire. En effet, les composés constituant ces matériaux contiennent immanquablement des impuretés qui absorbent la lumière et transfèrent l’énergie aux molécules voisines susceptibles alors de se dégrader. C’est le cas par exemple des plastiques.Applications de la photochimieParmi les réactions photochimiques les mieux comprises, on peut citer l’isomérisation cis-trans des composés alcéniques par excitation directe (état singulet excité) ou photosensibilisée (état triplet). En prenant le cas du 1,2 dichloroéthylène déjà cité à propos de la différence de conformation des molécules à l’état fondamental et à l’état excité, on comprend facilement que la désactivation de l’état excité peut aussi bien conduire à la molécule initiale cis qu’à la molécule trans .Un résultat spectaculaire annoncé dans les années soixante concerne l’isomérisation du benzène à l’état liquide qui donne (fig. 2), sous l’influence d’un rayonnement de longueur d’onde 253,7 nm (lampe à vapeur de mercure), du benzvalène (a) et du fulvène (b), alors que, irradié dans le domaine 166-200 nm, il donne du fulvène (a), du benzvalène (b) et du benzène dit de Dewar (c):Les réactions photochimiques ont eu, sans aucun doute, un rôle déterminant dans l’évolution de l’atmosphère terrestre et, par voie de conséquence, dans la vie sur notre planète.Avant l’apparition de la vie, la source principale d’oxygène a dû être la photolyse de l’eau, mais la concentration devait être très faible, environ mille fois moins élevée que la concentration actuelle. Cela semble confirmé par le fait que les molécules qui sont à l’origine des substances du monde vivant sont détruites par la lumière solaire en présence d’oxygène. La quantité actuelle d’oxygène est due essentiellement au processus de photosynthèse.Un problème qui revêt aujourd’hui une grande importance est la pollution atmosphérique dont certains aspects sont d’ordre photochimique (smog photochimique). La lumière solaire agissant sur le mélange gazeux issu des tuyaux d’échappement des automobiles et constitué par de l’oxyde nitrique NO et des hydrocarbures, en présence d’oxygène, produit de l’ozone 3 et de l’anhydride nitreux 2 en quantité suffisante parfois, par exemple à Los Angeles, pour irriter les voies respiratoires et colorer l’atmosphère.La photosynthèse est certes le processus biologique le plus important dépendant de la lumière. La lumière du soleil absorbée par la chlorophylle, associée à d’autres composés dans le chloroplaste, donne lieu à des réactions complexes que l’on peut globalement et schématiquement représenter par: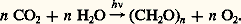 Il s’agit essentiellement d’un système capable de capter l’énergie du rayonnement solaire et de transférer l’énergie au milieu environnant qui l’utilise pour dissocier l’eau et réduire l’anhydride carbonique. Le bilan énergétique fait apparaître l’absorption de six quanta environ par molécule de gaz carbonique transformée.Le phénomène primaire de la vision est aussi un processus photochimique qui a lieu dans les cellules en bâtonnets et en cônes de la rétine. La lumière agit sur le rétinal, composé étroitement lié à la vitamine A, qui se trouve dans le pigment visuel. L’étape primaire semble être la photo-isomérisation du 11-cis- rétinal, en rétinal totalement trans. Cette réaction du pigment visuel, sensible à l’action d’un seul photon, serait capable d’activer un bâtonnet. Il faut cependant plusieurs quanta pour produire une sensation visuelle. Bien que des organes très perfectionnés de la vision se soient développés sous des aspects très différents, chez les Arthropodes, chez les Mollusques et chez les Vertébrés, le processus primaire de la vision est identique dans tous les cas.Industriellement, la photochimie a fait sa plus grande percée dans le domaine de la fixation des polymères sur différentes surfaces, par exemple le «séchage» des encres d’imprimerie ou la fabrication de circuits électroniques.
Il s’agit essentiellement d’un système capable de capter l’énergie du rayonnement solaire et de transférer l’énergie au milieu environnant qui l’utilise pour dissocier l’eau et réduire l’anhydride carbonique. Le bilan énergétique fait apparaître l’absorption de six quanta environ par molécule de gaz carbonique transformée.Le phénomène primaire de la vision est aussi un processus photochimique qui a lieu dans les cellules en bâtonnets et en cônes de la rétine. La lumière agit sur le rétinal, composé étroitement lié à la vitamine A, qui se trouve dans le pigment visuel. L’étape primaire semble être la photo-isomérisation du 11-cis- rétinal, en rétinal totalement trans. Cette réaction du pigment visuel, sensible à l’action d’un seul photon, serait capable d’activer un bâtonnet. Il faut cependant plusieurs quanta pour produire une sensation visuelle. Bien que des organes très perfectionnés de la vision se soient développés sous des aspects très différents, chez les Arthropodes, chez les Mollusques et chez les Vertébrés, le processus primaire de la vision est identique dans tous les cas.Industriellement, la photochimie a fait sa plus grande percée dans le domaine de la fixation des polymères sur différentes surfaces, par exemple le «séchage» des encres d’imprimerie ou la fabrication de circuits électroniques.
photochimie [ fɔtoʃimi ] n. f. ♦ Sc. Étude des réactions chimiques en relation avec l'énergie rayonnante (et spécialt des transformations de la matière sous l'influence du spectre compris entre l'ultraviolet extrême et le début de l'infrarouge).
● photochimie nom féminin Étude des transformations chimiques provoquées ou accélérées par la lumière.photochimien. f. CHIM étude des réactions chimiques produites ou favorisées par la lumière.⇒PHOTOCHIMIE, subst. fém.CHIM. Étude de l'action de la lumière ou de toute énergie rayonnante (rayons X ou particules nucléaires) sur les réactions chimiques. La photochimie est le domaine d'étude d'un milieu réactionnel dans lequel des molécules d'une espèce donnée se trouvent sélectivement portées dans un état excité (...) riche en énergie (Encyclop. univ. t.12 1972, p.1004).— En partic. Étude des transformations de la matière sous l'effet des rayons lumineux compris entre l'ultraviolet et l'infrarouge. Parallèlement au développement de la photochimie et de ses applications biologiques, les progrès théoriques permirent de relier de façon définitive l'ultraviolet au spectre visible (Hist. gén. sc., t.3, vol. 1, 1961, p.164).REM. Photochimique, adj. Qui relève des effets chimiques provoqués par la lumière ou une énergie rayonnante, qui est provoqué par ces effets. Réaction photochimique. Il s'agit d'obtenir, par un procédé photochimique, une gravure en taille-douce (dont les traits sont en creux dans le métal) (PRINET, Phot., 1945, p.60). Les huiles végétales (...) subissent, sous l'effet du rayonnement solaire, des transformations photochimiques qui peuvent aboutir à la destruction totale du film (ROMANOVSKY, Mer, source én., 1950, p.68).Prononc.:[ ], [foto-]. Étymol. et Hist. 1874 (Lar. 19e). Comp. de l'élém. formant photo-1 «lumière» et de chimie.photochimie [fɔtoʃimi] n. f.ÉTYM. 1865; de photo-, et chimie.❖♦ Sc. Étude des réactions chimiques en relation avec l'énergie rayonnante (et, spécialt, des transformations de la matière sous l'influence du spectre compris entre l'ultraviolet extrême et le début de l'infrarouge).➪ tableau Noms de sciences et d'activités à caractère scientifique.❖DÉR. Photochimique.
], [foto-]. Étymol. et Hist. 1874 (Lar. 19e). Comp. de l'élém. formant photo-1 «lumière» et de chimie.photochimie [fɔtoʃimi] n. f.ÉTYM. 1865; de photo-, et chimie.❖♦ Sc. Étude des réactions chimiques en relation avec l'énergie rayonnante (et, spécialt, des transformations de la matière sous l'influence du spectre compris entre l'ultraviolet extrême et le début de l'infrarouge).➪ tableau Noms de sciences et d'activités à caractère scientifique.❖DÉR. Photochimique.
Encyclopédie Universelle. 2012.
